Termodynamik är en viktig gren av fysiken. Vi kan säkert säga att dess prestationer har lett till framväxten av den tekniska eran och till stor del har bestämt den mänskliga historiens gång under de senaste 300 åren. Artikeln diskuterar termodynamikens första, andra och tredje lag och deras tillämpning i praktiken.
Vad är termodynamik?
Innan vi formulerar termodynamikens lagar, låt oss ta reda på vad den här delen av fysiken gör.
Ordet "termodynamik" är av grekiskt ursprung och betyder "rörelse på grund av värme". Det vill säga, denna gren av fysiken är engagerad i studier av alla processer, som ett resultat av vilka termisk energi omvandlas till mekanisk rörelse och vice versa.
Termodynamikens grundläggande lagar formulerades i mitten av 1800-talet. Vetenskapen om "rörelse och värme" överväger beteendet hos hela systemet som helhet, studerar förändringen i dess makroskopiska parametrar - temperatur, tryck och volym, och inte uppmärksammar dess mikroskopiska struktur. Dessutom spelar den första av dem en grundläggande roll i utformningen av lagartermodynamik i fysik. Det är konstigt att notera att de enbart härrör från experimentella observationer.
Konceptet med ett termodynamiskt system

Det betyder vilken grupp av atomer, molekyler eller andra element som helst som betraktas som en helhet. Alla tre lagarna är formulerade för det så kallade termodynamiska systemet. Exempel är: jordens atmosfär, alla levande organismer, gasblandningen i en förbränningsmotor, etc.
Alla system inom termodynamik tillhör en av tre typer:
- Öppet. De utbyter både värme och materia med miljön. Till exempel, om mat tillagas i en gryta på öppen eld, så är detta ett levande exempel på ett öppet system, eftersom grytan får energi från den yttre miljön (eld), medan den själv utstrålar energi i form av värme, och vatten avdunstar också därifrån (metabolism).
- Stängt. I sådana system sker inget utbyte av materia med miljön, även om utbyte av energi sker. Återgå till föregående fall: om du täcker vattenkokaren med ett lock kan du få ett slutet system.
- Isolerad. Detta är ett slags termodynamiska system som inte byter materia eller energi med det omgivande rummet. Ett exempel skulle vara en termos som innehåller varmt te.
Termodynamisk temperatur

Detta koncept betyder den kinetiska energin hos partiklarna som bildar de omgivande kropparna, vilket återspeglar hastighetenslumpmässig rörelse av partiklar. Ju större den är, desto högre temperatur. Följaktligen, genom att minska den kinetiska energin i systemet, kyler vi det.
Detta koncept betyder den kinetiska energin hos partiklarna som bildar de omgivande kropparna, vilket återspeglar hastigheten i partiklarnas kaotiska rörelse. Ju större den är, desto högre temperatur. Följaktligen, genom att minska den kinetiska energin i systemet, kyler vi det.
Termodynamisk temperatur uttrycks i SI (International System of Units) i Kelvin (till ära av den brittiske vetenskapsmannen William Kelvin, som först föreslog denna skala). Att förstå termodynamikens första, andra och tredje lag är omöjligt utan en definition av temperatur.
En division av en grad på Kelvin-skalan motsvarar också en grad Celsius. Omvandlingen mellan dessa enheter utförs enligt formeln: TK =TC + 273, 15, där TK och TC - temperaturer i kelvin respektive grader Celsius.
Det speciella med Kelvin-skalan är att den inte har negativa värden. Noll i den (TC=-273, 15 oC) motsvarar tillståndet när den termiska rörelsen för systemets partiklar är helt frånvarande, de verkar vara "frysta".
Bevarande av energi och termodynamikens första lag

År 1824 kom Nicolas Léonard Sadi Carnot, en fransk ingenjör och fysiker, med ett djärvt förslag som inte bara ledde till fysikens utveckling, utan också blev ett stort steg i teknikens förbättring. Hanskan formuleras enligt följande: "Energi kan inte skapas eller förstöras, den kan bara överföras från ett tillstånd till ett annat."
I själva verket postulerar Sadi Carnots fras lagen om bevarande av energi, som utgjorde grunden för termodynamikens första lag: "Närhelst ett system tar emot energi utifrån, omvandlar det den till andra former, de viktigaste av som är termiska och mekaniska."
Den matematiska formeln för den första lagen är skriven på följande sätt:
Q=ΔU + A, här är Q mängden värme som överförs av omgivningen till systemet, ΔU är förändringen i den interna energin i detta system, A är det perfekta mekaniska arbetet.
Adiabatiska processer
Ett bra exempel på dem är luftmassornas rörelse längs bergssluttningarna. Sådana massor är enorma (kilometer eller mer), och luft är en utmärkt värmeisolator. De noterade egenskaperna gör att vi kan betrakta alla processer med luftmassor som sker inom kort tid som adiabatiska. När luft stiger uppför en bergssluttning sjunker dess tryck, den expanderar, det vill säga den utför mekaniskt arbete, och som ett resultat kyler den. Tvärtom, den nedåtgående rörelsen av luftmassan åtföljs av en ökning av trycket i den, den komprimeras och blir på grund av detta mycket varm.
Tillämpningen av termodynamikens lag, som diskuterades i föregående underrubrik, demonstreras enklast med exemplet på en adiabatisk process.
Enligt definitionen, som ett resultat av det finns det inget utbyte av energi medmiljö, det vill säga i ekvationen ovan, Q=0. Detta leder till följande uttryck: ΔU=-A. Minustecknet här betyder att systemet utför mekaniskt arbete genom att minska sin egen inre energi. Man bör komma ihåg att den interna energin är direkt beroende av systemets temperatur.
Riktning av termiska processer
Det här numret handlar om termodynamikens andra lag. Alla märkte säkert att om du tar två föremål med olika temperaturer i kontakt, kommer den kalla alltid att värmas upp och den varma kommer att svalna. Observera att den omvända processen kan inträffa inom ramen för termodynamikens första lag, men den implementeras aldrig i praktiken.
Orsaken till irreversibiliteten för denna process (och alla kända processer i universum) är övergången av systemet till ett mer troligt tillstånd. I det övervägda exemplet med kontakten mellan två kroppar med olika temperaturer kommer det mest sannolika tillståndet att vara det där alla partiklar i systemet kommer att ha samma kinetiska energi.
Termodynamikens andra lag kan formuleras enligt följande: "Värme kan aldrig spontant överföras från en kall kropp till en varm." Om vi introducerar begreppet entropi som ett mått på oordning, så kan det representeras på följande sätt: "All termodynamisk process fortskrider med en ökning av entropi".
Värmemotor

Denna term förstås som ett system som, på grund av tillförseln av extern energi till det, kan utföra mekaniskt arbete. Förstvärmemotorer var ångmaskiner och uppfanns i slutet av 1600-talet.
Termodynamikens andra lag spelar en avgörande roll för att bestämma deras effektivitet. Sadi Carnot fastställde också att den här enhetens maximala effektivitet är: Effektivitet=(T2 - T1)/T2, här är T2 och T1 värmare och kylskåpstemperaturer. Mekaniskt arbete kan endast utföras när det finns ett värmeflöde från en varm kropp till en kall, och detta flöde kan inte till 100 % omvandlas till användbar energi.
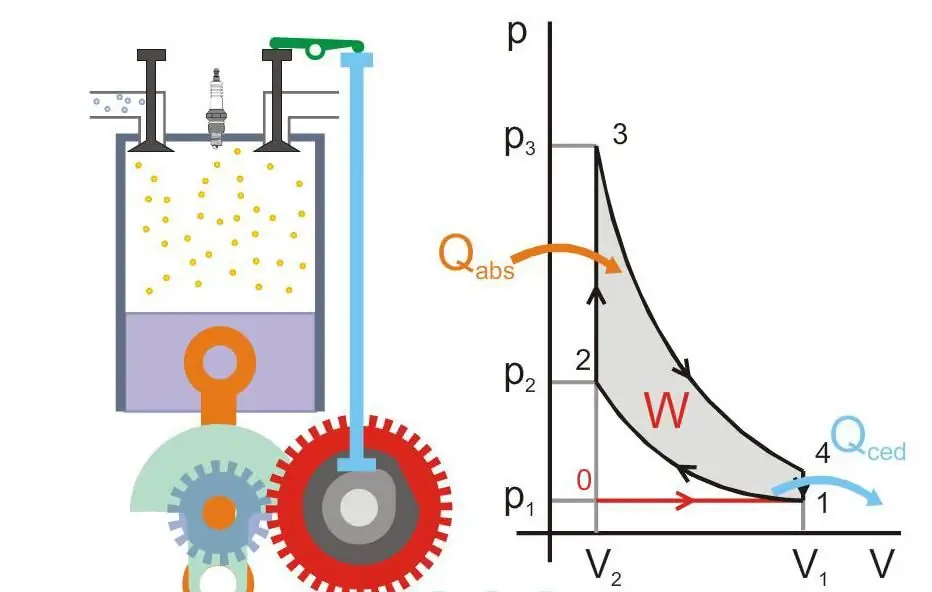
Figuren nedan visar principen för driften av en värmemotor (Qabs - värme överförs till maskinen, Qced - värmeförlust, W - nyttigt arbete, P och V - tryck och volym gas i kolven).
Absolut noll och Nernsts postulat
Låt oss slutligen gå vidare till övervägandet av termodynamikens tredje lag. Det kallas också för Nernst-postulatet (namnet på den tyska fysikern som formulerade det först i början av 1900-talet). Lagen säger: "Absolut noll kan inte uppnås med ett begränsat antal processer." Det vill säga, det är omöjligt på något sätt att helt "frysa" ett ämnes molekyler och atomer. Anledningen till detta är det konstanta befintliga värmeväxlingen med omgivningen.

En användbar slutsats från termodynamikens tredje lag är att entropin minskar när man rör sig mot absoluta nollpunkten. Detta innebär att systemet tenderar att organisera sig. Detta faktum kananvänd till exempel för att överföra paramagneter till ett ferromagnetiskt tillstånd när de kyls.
Det är intressant att notera att den lägsta temperaturen som har uppnåtts hittills är 5·10−10 K (2003, MIT laboratory, USA).






