Det tredimensionella tillståndet för flytande vatten är svårt att studera, men mycket har lärt sig genom att analysera iskristallernas struktur. Fyra angränsande väte-interagerande syreatomer upptar hörnen på en tetraeder (tetra=fyra, hedron=plan). Den genomsnittliga energi som krävs för att bryta en sådan bindning i is uppskattas till 23 kJ/mol-1.

Förmågan hos vattenmolekyler att bilda ett givet antal vätekedjor, samt en given styrka, skapar en ovanligt hög smältpunkt. När det smälter hålls det av flytande vatten, vars struktur är oregelbunden. De flesta av vätebindningarna är förvrängda. Det krävs en stor mängd energi i form av värme för att bryta kristallgittret av vätebunden is.
Funktioner för isens utseende (Ih)
Många av invånarna undrar vilken typ av kristallgitter is har. NödvändigDet bör noteras att densiteten hos de flesta ämnen ökar under frysning, när molekylära rörelser saktar ner och tätt packade kristaller bildas. Vattnets densitet ökar också när det svalnar till ett maximum vid 4°C (277K). Sedan, när temperaturen faller under detta värde, expanderar den.
Denna ökning beror på bildandet av en öppen, vätebunden iskristall med dess gitter och lägre densitet, där varje vattenmolekyl är styvt bunden av ovanstående element och fyra andra värden, samtidigt som de rör sig tillräckligt snabbt för att ha mer massa. Eftersom denna åtgärd inträffar fryser vätskan uppifrån och ner. Detta har viktiga biologiska resultat, som ett resultat av vilka islagret på dammen isolerar levande varelser från extrem kyla. Dessutom är två ytterligare egenskaper hos vatten relaterade till dess väteegenskaper: specifik värme och förångning.
Detaljerad beskrivning av strukturer
Det första kriteriet är den mängd som behövs för att höja temperaturen på 1 gram av ett ämne med 1°C. Att höja graderna av vatten kräver en relativt stor mängd värme eftersom varje molekyl är involverad i många vätebindningar som måste brytas för att den kinetiska energin ska öka. Förresten, förekomsten av H2O i celler och vävnader hos alla stora flercelliga organismer gör att temperaturfluktuationer inuti cellerna minimeras. Denna funktion är avgörande, eftersom hastigheten för de flesta biokemiska reaktionerkänslig.
Vattnets förångningsvärme är också betydligt högre än för många andra vätskor. Det krävs en stor mängd värme för att omvandla denna kropp till en gas, eftersom vätebindningarna måste brytas för att vattenmolekylerna ska lossna från varandra och gå in i nämnda fas. Föränderliga kroppar är permanenta dipoler och kan interagera med andra liknande föreningar och de som joniserar och löser sig.
Andra ämnen som nämns ovan kan bara komma i kontakt om polaritet finns. Det är denna förening som är involverad i strukturen av dessa element. Dessutom kan den rikta sig runt dessa partiklar som bildas av elektrolyter, så att de negativa syreatomerna i vattenmolekylerna är orienterade mot katjonerna, och de positiva jonerna och väteatomerna är orienterade mot anjonerna.
I fasta ämnen bildas som regel molekylära kristallgitter och atomära. Det vill säga, om jod är byggt på ett sådant sätt att det innehåller I2, , så är CO2 molekyler i fast koldioxid, det vill säga i torris. belägen vid kristallgitternoderna . När is interagerar med liknande ämnen har is ett jonkristallgitter. Grafit, till exempel, som har en atomstruktur baserad på kol, kan inte ändra den, precis som diamant.
Vad händer när en kristall av bords alt löser sig i vatten: polära molekyler attraheras av laddade element i kristallen, vilket leder till att liknande partiklar av natrium och klorid bildas på dess yta, vilket resulterar i dessa kropparförskjuts från varandra, och det börjar lösas upp. Härifrån kan det observeras att is har ett kristallgitter med jonbindning. Varje upplöst Na + attraherar de negativa ändarna av flera vattenmolekyler, medan varje upplöst Cl - attraherar de positiva ändarna. Skalet som omger varje jon kallas flyktsfären och innehåller vanligtvis flera lager av lösningsmedelspartiklar.
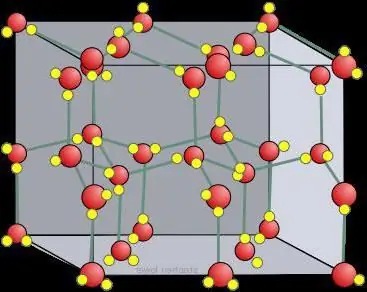
Torriskristallgitter
Variabler eller en jon omgiven av element sägs vara sulfaterad. När lösningsmedlet är vatten hydratiseras sådana partiklar. Således tenderar vilken polär molekyl som helst att solvatiseras av elementen i vätskekroppen. I torris bildar typen av kristallgitter atombindningar i aggregationstillståndet, som är oförändrade. En annan sak är kristallin is (fruset vatten). Joniska organiska föreningar som karboxylas och protonerade aminer måste vara lösliga i hydroxyl- och karbonylgrupper. Partiklarna i sådana strukturer rör sig mellan molekyler och deras polära system bildar vätebindningar med denna kropp.
Självklart påverkar antalet av de sist angivna grupperna i en molekyl dess löslighet, vilket också beror på reaktionen mellan olika strukturer i grundämnet: till exempel är en-, två- och trekolalkoholer blandbara med vatten, men större kolväten med enkla hydroxylföreningar är mycket mindre utspädda i vätskor.
Hexagonal Ih liknar till formenatomärt kristallgitter. För is och all naturlig snö på jorden ser det ut exakt så här. Detta bevisas av symmetrin hos kristallgittret av is, växt från vattenånga (det vill säga snöflingor). Den är i rymdgrupp P 63/mm från 194; D 6h, Laue klass 6/mm; liknar β-, som har en multipel av 6 spiralaxel (rotation runt förutom att skifta längs den). Den har en ganska öppen lågdensitetsstruktur där effektiviteten är låg (~1/3) jämfört med enkla kubiska (~1/2) eller ansiktscentrerade kubiska (~3/4) strukturer.
Jämfört med vanlig is är torrisens kristallgitter, bundet av CO2-molekyler, statiskt och förändras endast när atomer sönderfaller.
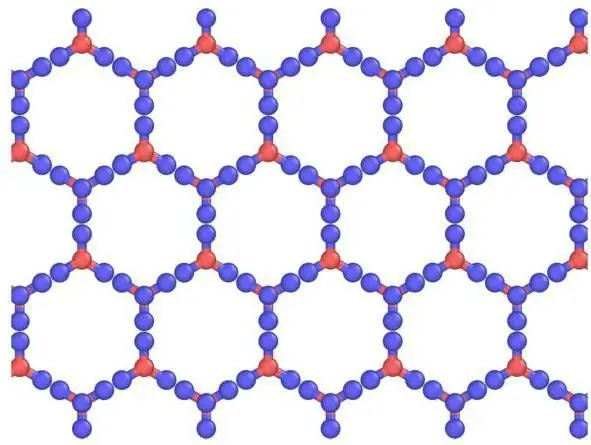
Beskrivning av galler och deras element
Kristaller kan ses som kristallina modeller, bestående av ark placerade ovanför varandra. Vätebindningen är ordnad, medan den i själva verket är slumpmässig, eftersom protoner kan röra sig mellan vatten (is) molekyler vid temperaturer över cirka 5 K. Det är faktiskt troligt att protoner beter sig som en kvantvätska i ett konstant tunnelflöde. Detta förstärks av spridningen av neutroner, som visar deras spridningstäthet halvvägs mellan syreatomerna, vilket indikerar lokalisering och samordnad rörelse. Här finns en likhet mellan is och ett atomärt, molekylärt kristallgitter.
Molekyler har ett förskjutet arrangemang av vätekedjanmed hänsyn till sina tre grannar i planet. Det fjärde elementet har ett förmörkat vätebindningsarrangemang. Det finns en liten avvikelse från perfekt hexagonal symmetri, eftersom enhetscellen är 0,3 % kortare i denna kedjas riktning. Alla molekyler upplever samma molekylära miljöer. Det finns tillräckligt med utrymme inuti varje "låda" för att hålla partiklar av interstitiellt vatten. Även om de inte anses allmänt har de nyligen detekterats effektivt genom neutrondiffraktion av isens pulverformiga kristallgitter.
Changing Substances
Den sexkantiga kroppen har trippelpunkter med flytande och gasformigt vatten 0,01 ° C, 612 Pa, fasta element - tre -21,985 ° C, 209,9 MPa, elva och två -199,8 ° C, 70 MPa, samt - 34,7°C, 212,9 MPa. Dielektricitetskonstanten för hexagonal is är 97,5.
Smältkurvan för detta element ges av MPa. Tillståndsekvationerna är tillgängliga, förutom dem, några enkla olikheter som relaterar förändringen i fysikaliska egenskaper till temperaturen på hexagonal is och dess vattenh altiga suspensioner. Hårdheten fluktuerar med grader som stiger från eller under gips (≦2) vid 0°C till fältspat (6 Mohs) vid -80°C, en onorm alt stor förändring i absolut hårdhet (> 24 gånger).
Det hexagonala kristallgittret av is bildar hexagonala plattor och kolumner, där de övre och nedre ytorna är basplanen {0 0 0 1} med en entalpi på 5,57 μJ cm -2, och andra ekvivalenta sidodelar kallas delar av prismat {1 0 -1 0} med 5, 94µJ cm -2. Sekundära ytor {1 1 -2 0} med 6,90 ΜJ ˣ cm -2 kan formas längs planen som bildas av strukturernas sidor.
En sådan struktur visar en onormal minskning av värmeledningsförmågan med ökande tryck (liksom kubisk och amorf is med låg densitet), men skiljer sig från de flesta kristaller. Detta beror på en förändring i vätebindningen, vilket minskar ljudets tvärhastighet i kristallgittret av is och vatten.
Det finns metoder som beskriver hur man förbereder stora kristallprover och valfri isyta. Det antas att vätebindningen på ytan av den hexagonala kroppen som studeras kommer att vara mer ordnad än inuti bulksystemet. Variationsspektroskopi med fas-gitterfrekvensgenerering har visat att det finns en strukturell asymmetri mellan de två övre skikten (L1 och L2) i HO-kedjan under ytan av den hexagonala isens basyta. De antagna vätebindningarna i de övre lagren av hexagonerna (L1 O ··· HO L2) är starkare än de som accepteras i det andra lagret till den övre ansamlingen (L1 OH ··· O L2). Interaktiva sexkantiga isstrukturer tillgängliga.
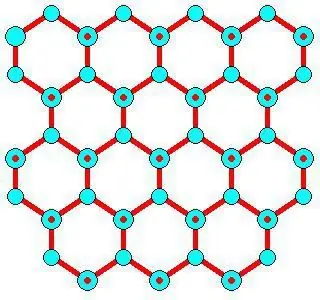
Utvecklingsfunktioner
Minsta antalet vattenmolekyler som behövs för att bilda is är ungefär 275 ± 25, som för ett komplett icosahedriskt kluster på 280. Bildning sker med en hastighet av 10 10 vid luft-vatten-gränssnitt och inte i bulkvatten. Tillväxten av iskristaller beror på olika tillväxthastigheter av olikaenergier. Vatten måste skyddas från frysning vid kryokonservering av biologiska prover, mat och organ.
Detta uppnås vanligtvis genom snabba nedkylningshastigheter, med användning av små prover och en kryokonservator, och ökat tryck för att bilda is och förhindra cellskador. Den fria energin av is/vätska ökar från ~30 mJ/m2 vid atmosfärstryck till 40 mJ/m-2 vid 200 MPa, vilket indikerar anledningen till att denna effekt uppstår.
Vilken typ av kristallgitter är karakteristisk för is
Alternativt kan de växa snabbare från prismaytor (S2), på den slumpmässigt störda ytan av snabbfrusna eller upprörda sjöar. Tillväxten från {1 1 -2 0} ytorna är åtminstone densamma, men förvandlar dem till prismabaser. Uppgifterna om utvecklingen av iskristallen har undersökts fullständigt. Den relativa tillväxthastigheten för element i olika ansikten beror på förmågan att bilda en stor grad av ledhydrering. Temperaturen (låg) på det omgivande vattnet bestämmer graden av förgrening i iskristallen. Partikeltillväxt begränsas av diffusionshastigheten vid en låg grad av underkylning, dvs. <2 °C, vilket resulterar i fler av dem.

Men begränsat av utvecklingskinetik vid högre nivåer av depression på >4°C, vilket resulterar i nåltillväxt. Denna form liknar strukturen hos torris (har ett kristallgitter med en hexagonal struktur), olikaegenskaper hos ytutvecklingen och temperaturen på det omgivande (superkylda) vattnet, som ligger bakom snöflingornas platta former.
Uppbildningen av is i atmosfären påverkar djupt bildandet och egenskaperna hos moln. Fältspat, som finns i ökendamm som kommer in i atmosfären i miljontals ton per år, är viktiga former. Datorsimuleringar har visat att detta beror på kärnbildningen av prismatiska iskristallplan på ytplan med hög energi.
Några andra element och galler
Upplösta ämnen (med undantag för mycket litet helium och väte, som kan komma in i mellanrummen) kan inte ingå i Ih-strukturen vid atmosfärstryck, utan tvingas ut till ytan eller det amorfa lagret mellan partiklarna i mikrokristallin kropp. Det finns några andra element vid gitterplatserna för torris: kaotropiska joner som NH4 + och Cl - som ingår i lättare vätskefrysning än andra kosmotropa sådana som Na + och SO42-, så att ta bort dem är inte möjligt på grund av att de bildar en tunn film av den kvarvarande vätskan mellan kristallerna. Detta kan leda till elektrisk laddning av ytan på grund av dissociation av ytvatten som balanserar de återstående laddningarna (vilket också kan leda till magnetisk strålning) och en förändring av pH för de kvarvarande vätskefilmerna, t.ex. NH 42SO4 blir surare och NaCl blir mer basiskt.
De är vinkelräta mot ansiktenakristallgitter av is som visar nästa lager fäst (med O-atomer i svart). De kännetecknas av en långsamt växande basal yta {0 0 0 1}, där endast isolerade vattenmolekyler är fästa. En snabbt växande {1 0 -1 0} yta av ett prisma där par av nyligen fästa partiklar kan binda till varandra med väte (en vätebindning/två molekyler av ett grundämne). Det snabbast växande ansiktet är {1 1 -2 0} (sekundär prismatisk), där kedjor av nyligen fästa partiklar kan interagera med varandra genom vätebindning. En av hennes kedjor/elementmolekyl är en form som bildar åsar som delar sig och uppmuntrar omvandling till två sidor av prismat.
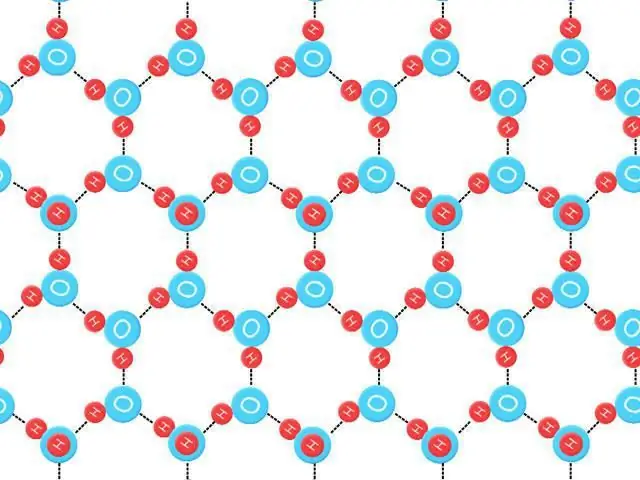
Nollpunktsentropi
Kan definieras som S 0=k B ˣ Ln (N E0), där k B är Boltzmann-konstanten, NE är antalet konfigurationer vid energin E, och E0 är den lägsta energin. Detta värde för entropin för hexagonal is vid noll Kelvin bryter inte mot termodynamikens tredje lag "Entropin för en ideal kristall vid absolut noll är exakt noll", eftersom dessa element och partiklar inte är idealiska, har en oordnad vätebindning.
I den här kroppen är vätebindningen slumpmässig och förändras snabbt. Dessa strukturer är inte exakt lika i energi, men sträcker sig till ett mycket stort antal energetiskt nära tillstånd, lyder "isens regler". Nollpunktsentropi är den störning som skulle finnas kvar även om materialet kunde kylas till absolutnoll (OK=-273, 15°C). Genererar experimentell förvirring för hexagonal is 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoretiskt skulle det vara möjligt att beräkna nollentropin för kända iskristaller med mycket större noggrannhet (försumma defekter och energinivåspridning) än att bestämma den experimentellt.
Forskare och deras arbete inom detta område
Kan definieras som S 0=k B ˣ Ln (N E0), där k B är Boltzmann-konstanten, NE är antalet konfigurationer vid energin E, och E0 är den lägsta energin. Detta värde för entropin för hexagonal is vid noll Kelvin bryter inte mot termodynamikens tredje lag "Entropin för en ideal kristall vid absolut noll är exakt noll", eftersom dessa element och partiklar inte är idealiska, har en oordnad vätebindning.
I den här kroppen är vätebindningen slumpmässig och förändras snabbt. Dessa strukturer är inte exakt lika i energi, men sträcker sig till ett mycket stort antal energetiskt nära tillstånd, lyder "isens regler". Nollpunktsentropi är den störning som skulle finnas kvar även om materialet kunde kylas till absolut noll (0 K=-273,15°C). Genererar experimentell förvirring för hexagonal is 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoretiskt skulle det vara möjligt att beräkna nollentropin för kända iskristaller med mycket större noggrannhet (försumma defekter och energinivåspridning) än att bestämma den experimentellt.

Även om ordningen för protoner i bulk is inte är ordnad, föredrar ytan förmodligen ordningen för dessa partiklar i form av band av hängande H-atomer och O-enkelpar (noll entropi med ordnade vätebindningar). Nollpunktsstörningen ZPE, J ˣ mol -1 ˣ K -1 och andra finns. Av allt ovanstående är det tydligt och förståeligt vilka typer av kristallgitter som är karakteristiska för is.






