Adiabatisk övergång mellan två tillstånd i gaser är inte en av isoprocesserna, men den spelar en viktig roll inte bara i olika tekniska processer, utan även i naturen. I den här artikeln kommer vi att överväga vad denna process är, och även ge de adiabatiska ekvationerna för en idealisk gas.
Ideal gas i korthet
En idealgas är en gas där det inte finns någon interaktion mellan dess partiklar och deras storlek är lika med noll. I naturen finns det naturligtvis inga hundraprocentiga idealgaser, eftersom de alla är sammansatta av molekyler och atomer av storlek, som alltid interagerar med varandra åtminstone med hjälp av van der Waals-krafter. Ändå utförs den beskrivna modellen ofta med tillräcklig noggrannhet för att lösa praktiska problem för många riktiga gaser.
Huvudekvationen för en idealgas är Clapeyron-Mendeleev-lagen. Det är skrivet i följande form:
PV=nRT.
Denna ekvation upprättar en direkt proportionalitet mellan produktentryck P på volymen V och mängden ämne n på den absoluta temperaturen T. Värdet på R är gaskonstanten, som spelar rollen som en proportionalitetsfaktor.
Vad är en adiabatisk process?
En adiabatisk process är en övergång mellan tillstånden i ett gassystem där det inte sker något utbyte av energi med miljön. I detta fall ändras alla tre termodynamiska egenskaperna hos systemet (P, V, T) och mängden ämne n förblir konstant.
Skillnad mellan adiabatisk expansion och sammandragning. Båda processerna sker endast på grund av systemets inre energi. Så, som ett resultat av expansion, sjunker trycket och speciellt temperaturen i systemet dramatiskt. Omvänt resulterar adiabatisk kompression i ett positivt hopp i temperatur och tryck.
För att förhindra värmeväxling mellan omgivningen och systemet måste det senare ha värmeisolerade väggar. Dessutom minskar en förkortning av processtiden avsevärt värmeflödet till och från systemet.
Poisson-ekvationer för en adiabatisk process

Termodynamikens första lag är skriven enligt följande:
Q=ΔU + A.
Med andra ord, värmen Q som kommuniceras till systemet används för att utföra arbete A av systemet och för att öka dess interna energi ΔU. För att skriva den adiabatiska ekvationen bör man sätta Q=0, vilket motsvarar definitionen av den process som studeras. Vi får:
ΔU=-A.
Med isokoriskprocess i en idealisk gas går all värme till att öka den inre energin. Detta faktum tillåter oss att skriva likheten:
ΔU=CVΔT.
Där CV är den isokoriska värmekapaciteten. Arbete A beräknas i sin tur enligt följande:
A=PdV.
Där dV är en liten volymförändring.
Förutom Clapeyron-Mendeleev-ekvationen, gäller följande ekvation för en idealisk gas:
CP- CV=R.
Där CP är den isobariska värmekapaciteten, som alltid är större än den isokoriska, eftersom den tar hänsyn till gasförluster på grund av expansion.
När vi analyserar ekvationerna skrivna ovan och integrerar temperatur och volym, kommer vi fram till följande adiabatiska ekvation:
TVγ-1=konst.
Här är γ det adiabatiska indexet. Det är lika med förhållandet mellan isobar värmekapacitet och isokorisk. Denna likhet kallas Poisson-ekvationen för en adiabatisk process. Genom att tillämpa Clapeyron-Mendeleev-lagen kan du skriva ytterligare två liknande uttryck, endast genom parametrarna P-T och P-V:
TPγ/(γ-1)=const;
PVγ=konst.
Adiabatisk graf kan ges i olika axlar. Nedan visas den i P-V-axlar.
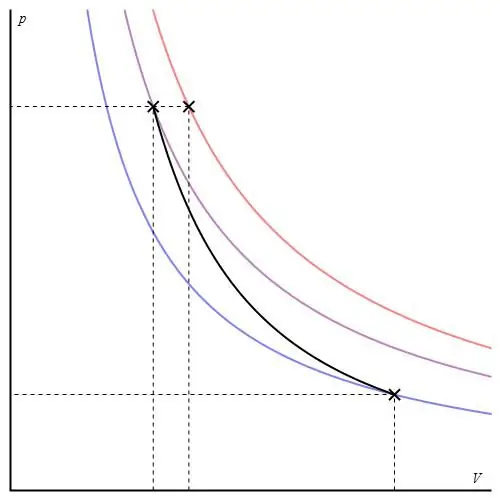
Färgade linjer på grafen motsvarar isotermer, den svarta kurvan är en adiabat. Som kan ses beter sig adiabaten skarpare än någon av isotermerna. Detta faktum är lätt att förklara: för isotermen ändras trycket tillbakaproportionell mot volymen, men för isobaten ändras trycket snabbare, eftersom exponenten är γ>1 för vilket gassystem som helst.
Exempelproblem
I naturen, i bergsområden, när luftmassan rör sig uppför sluttningen sjunker dess tryck, den ökar i volym och svalnar. Denna adiabatiska process sänker daggpunkten och ger flytande och fast utfällning.

Följande problem föreslås lösas: i processen att lyfta luftmassan längs bergets sluttning, sjönk trycket med 30 % jämfört med trycket vid foten. Vad var dess temperatur lika med om den vid foten var 25 oC?
För att lösa problemet, använd följande adiabatiska ekvation:
TPγ/(γ-1)=konst.
Det är bättre att skriva det i denna form:
T2/T1=(P2/P 1)(γ-1)/γ.
Om P1 tas som 1 atmosfär, kommer P2 att vara lika med 0,7 atmosfärer. För luft är det adiabatiska indexet 1,4, eftersom det kan betraktas som en diatomisk idealgas. Temperaturvärdet för T1 är 298,15 K. Genom att ersätta alla dessa siffror i uttrycket ovan får vi T2=269,26 K, vilket motsvarar - 3, 9 oC.






